Společný výzkum objasňuje, jak vzniká bolest
Vědci z Fyziologického ústavu AV ČR ve spolupráci s Fyzikálním ústavem MFF UK zkoumají receptory, které se uplatňují při vzniku chronické bolesti. Jejich společnou studii včera zveřejnil prestižní časopis Science Signaling.
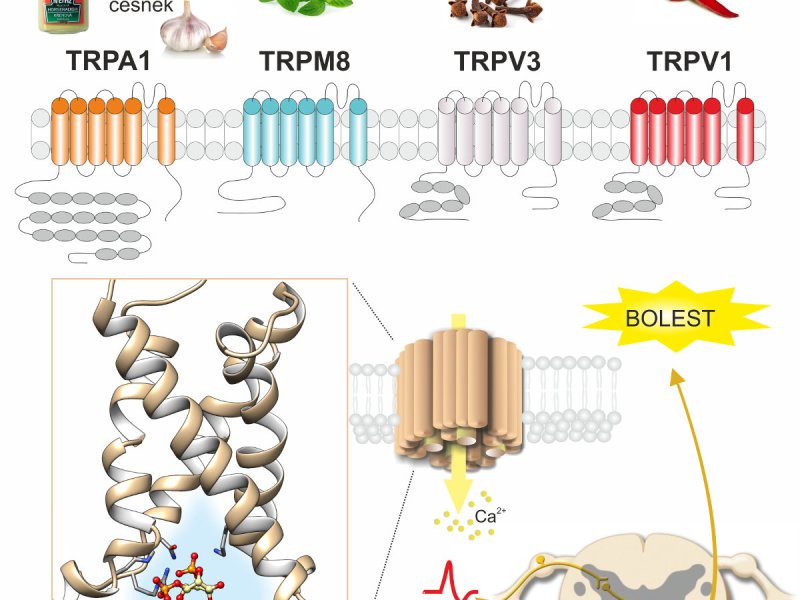
O přežití všech živých organismů často rozhoduje schopnost včas rozpoznat potenciálně škodlivé nebo bolestivé podněty. U savců jsou takovým „poplašným systémem“ specializované neurony, tzv. nociceptory. Na jejich periferních zakončeních jsou zabudovány proteinové receptory, jež jsou schopny bezprostředně detekovat bolestivý podnět a převést tuto informaci na elektrický signál.
Vědci z oddělení buněčné neurofyziologie Fyziologického ústavu Akademie věd ČR dlouhodobě studují funkční vlastnosti těchto receptorů. Ve spolupráci s výpočtáři z oddělení fyziky biomolekul Fyzikálního ústavu Matematicko-fyzikální fakulty UK nyní získali zcela nové informace o struktuře nociceptivního iontového kanálu TRPA1. Ty by měly přispět nejen k lepšímu porozumění mechanismům vzniku bolesti, ale také k vyhledání nových míst, kam se mohou vázat látky s analgetickým účinkem.
Iontový kanál TRPA1 je modulován celou řadou chemických či fyzikálních podnětů. Mohou to být pálivé látky rostlinného původu (např. ze skořice a hořčice), různé molekuly uvolňované při zranění nebo zánětu, ale i změny membránového napětí, okolní teploty či tlaku. Tyto podněty aktivují TRPA1 alosterickým způsobem, to znamená, že odpověď kanálu na jeden podnět mění jeho odpověď na podnět jiný. Prostřednictvím experimentálně vnesených mutací v evolučně konzervovaných oblastech receptoru TRPA1 a pomocí počítačového modelování struktury tohoto receptoru na atomární úrovni autoři charakterizovali intracelulární oblast v senzorové části kanálu vytvářející kavitu, která koordinuje tento komplikovaný alosterický mechanizmus aktivace.
Mutace některých aminokyselin v kavitě senzoru například zabraňují interakci s intracelulárními fosfolipidy, což v konečném důsledku naruší citlivost receptoru k vápenatým iontům, nebo membránovému napětí.
Tisková zpráva FGÚ AV ČR, v.v.i.
L. Zimova, V. Sinica, A. Kadkova, L. Vyklicka, V. Zima, I. Barvik, V. Vlachova, Intracellular cavity of sensor domain controls allosteric gating of TRPA1 channel. Science Signaling, 2018, vol. 11, Issue 514, DOI: 10.1126/scisignal.aan8621